Pojecie atomu
Słowa atom używano już w IV wieku p.n.e.. Po raz pierwszy użył go Demokryt, grecki filozof
z Abwery. Pochodzi od „Athomos” znaczy niepodzielny w języku greckim. Dopiero w XIX udowodniono, że atom zbudowany jest z jeszcze mniejszych cząstek.
Postulaty teorii Daltona
John Dalton, angielski uczony, opracował w 1804r. tezę atomistyczno - cząsteczkową budowy materii. We współczesnej formie jest ona aktualna do dzisiaj.
Jej postulaty zakładają, że:
- Pierwiastek chemiczny złożony jest z bardzo małych cząstek, które nazwano atomami.
- Wszystkie atomy danego pierwiastka wykazują identyczne właściwości chemiczne.
- Atomy należące do różnych pierwiastków cechują się odrębnymi własnościami fizycznymi oraz chemicznymi. W przyrodzie jest tyle atomów ile pierwiastków.
- Atom określonego pierwiastka nie ulega przekształceniu w innego rodzaju atom (który charakteryzuje inny pierwiastek) w wyniku standardowej reakcji chemicznej.
- Tworzenie związków chemicznych przez pierwiastki jest związane z łączeniem różnych atomów (należących do różnych pierwiastków) w wyniku czego powstają cząsteczki.
- Związek chemiczny składa się cząsteczek. Cząsteczki, wchodzące w skład związku chemicznego,
- są identyczne pod względem budowy i właściwości.
- Rozkład związku chemicznego następuje w wyniku rozpadu cząsteczek na atomy pierwiastków.
- Atomy należące do tego samego pierwiastka również mogą tworzyć cząsteczki.
Modele budowy atomu:
- Rutherforda - atom składa się z dodatnio naładowanego jądra oraz umieszczonych „jak rodzynki w cieście” elektronów
Angielski fizyk i profesor Uniwersytetu w Cambridge Ernest Rutheford (1871-1937) stworzył teorię rozpadu promieniotwórczego, stworzył planetarny model budowy atomu, a także odkrył pierwszą przeprowadzona w sposób sztuczny reakcję jądrową, a w 1908r. został laureatem Nagrody Nobla w dyscyplinie chemii.
Prowadząc eksperyment polegający na „bombardowaniu” folii metalowej cząstkami α spostrzegł, że jedynie niektóre z nich rozpraszają się lub odbijają, zaś zdecydowana większość ulega przejściu przez folię. Bazując na tym doświadczeniu opracował on planetarny model atomu. W 1911r. Rutheford ogłosił swoja teorię, głoszącą że atom złożony jest z dodatnio naładowanego jądra (skupiającego większość masy) i lekkich elektronów poruszających się z bardzo dużą prędkością w próżni wokół jądra.
Protonem zostało nazwane jądro atomu wodoru, (najprostsze jądro) i oznaczono symbolem p. Posiada ono jeden elementarny ładunek dodatni, który jest równy wartości ładunkowi elektronu. Dopiero dalsze doświadczenia dowiodły, że jądro zbudowane jest z protonów. Cząstka ta jest trwałą cząsteczką elementarną o masie 1,007 u (jednostka masy atomowej), 1836 razy większą niż masa elektronu. Jednostkowy elementarny ładunek protonu oznaczony został przez 1, a średnica wynosi ok. 10-14 m.
Wprowadzone zostało także pojęcie liczby atomowej Z, jako liczby protonów budujących jądro atomowe. Taka sama ilość protonów wchodzących w skład jądra jest charakterystyczna dla danego pierwiastka, tak więc wszystkie atomy określonego pierwiastka posiadają w jądrach identyczną ilość protonów.
- Bohra – atom posiada dodatnie jądro oraz elektrony krążące po orbitach o określonej energii.
Według modelu Bohra elektrony poruszają się po orbitach (powłoki), tak jak Ziemia wokół Słońca. Mogą one przechodzić z jednej powłoki na drugą czemu towarzyszy absorpcja lub emisja energii. Wartość energii dla elektronu zależy od odległości od jądra (im dalej tym jest większa). Energia elektronu może zmieniać się jedynie w sposób skokowy (skwantowany), co wiąże się z tym, ze elektron musi pochłonąć ściśle określoną porcje energii. Stan o wyższej energii jest nietrwały i nosi on nazwę go stanu wzbudzonego.
Przejście z jednej na drugą orbitę związane jest z emisją kwantu energii (najmniejsza porcja energii), a gdy jest nią świetlna energia, następuje emisja fotonu:
E=hV,
Gdzie h – stała Plancka
V- częstość
Bohr stwierdził, że jeśli elektrony znajdują się na najniższych możliwych poziomach to mamy do czynienia ze staniem podstawowym (stacjonarnym).
Przeskok z jednego (1) stanu do drugiego (2) jest zawsze związane z emisją albo absorpcją energii wynoszącej E=E 2 - E 1.
Jądro atomowe zbudowane jest z protonów oraz neutronów. Liczbę protonów określa liczba atomowa
Z (posiadająca taką samą wartość jak liczba porządkowej). Pierwiastek charakteryzuje również liczba masowa A, będąca liczba nukleonów, czyli sumy protonów oraz neutronów w jadrze atomowym.
Elektrony, znajdujące się wokół jądra posiadają ładunek ujemny, podczas gdy neutrony nie posiadają ładunku elektrycznego, protony - elementarny ładunek dodatni.
Liczbę neutronów określa się wyrażeniem:
n = A- Z
Zazwyczaj liczba neutronów w pierwiastkach lżejszych jest taka sama jak liczba protonów, a w pierwiastkach
o dużych liczbach atomowych ilość neutronów jest większa niż protonów.
- Angielski fizyk John Josef Thomson (1856-1940), prowadząc badania odnoszące się do budowy materii
- i struktury elektryczności, odkrył elektron w 1896 r. Podczas badań wyładowań w rozrzedzonych gazach wykrył istnienie jeszcze mniejszej od atomu cząstki, o elementarnym ładunku ujemnym.
Elektron (symbol e) jest cząstkę o masie 9,11*10-31 kg (czyli ok. 0,00055u ) i średnicy ok 10-14 m.
Odkrycie promieniotwórczości przez Becquerela (Henri Becquerel wraz z małżeństwem Curie otrzymał nagrodę w 1903r.) i promieniotwórczych pierwiastków chemicznych - radu oraz polonu przez małżeństwo Curie (1898r.) potwierdziły przypuszczenia o podzielności atomu.
Promieniowanie β, zauważone przez Thompsona jest strumieniem elektronów. Istnieją także jeszcze dwa inne: α i γ . Pierwsze z nich jest związane z cząstki alfa, czyli jądrami helu.
Alotropia
Pierwiastki mogą występować w paru różnych odmianach, różniących się strukturą oraz własnościami fizycznymi. Zjawisko to określa się wielopostaciowością albo alotropią.
Przykłady:
- Odmiany tlenu:
- O2
- O3
- Odmiany węgla:
- Grafit
- Diament
- Fulleren
Budowa atomu
Atom jest najmniejszą częścią pierwiastka chemicznego. Jako układ elektrycznie obojętny, posiada dodatnio naładowane jądro oraz elektrony niosące ładunek ujemny.
Jądro atomowe składa się z nukleonów, w skład których wchodzą protony i neutrony. Neutrony oraz protony znacznie przewyższają masę od elektronów ok. 2000 razy, dlatego decydują one o masie prawie całego atomu (ok. 99,9%).
Proton posiada elementarny ładunek dodatni, a jego masa wynosi 1,007 u.
Neutron został odkryty w 1932r. przez brytyjskiego chemika Jamesa Chadwicka. Ta cząstka elementarna wchodzi w skład jąder atomowych wszystkich pierwiastków, w różnej ilości, poza jednym z izotopów wodoru. Charakteryzuje się ponadto tym, że jest elektrycznie obojętny elektrycznie, a jego masa wynosi 1,009 u. Neutrony występujące w jądrach atomowych wykazują się znaczną trwałością, w odróżnieniu od neutronów wolnych, które ulegają rozpadowi na protony, elektrony oraz antyneutrina. Średni okres połowicznego rozpadu neutronów swobodnych waha się w granicach 700 s.
Za trwałość jądra odpowiadają siły jądrowe działające pomiędzy nukleonami, charakteryzują się bardzo małym zasięgiem (rzędu 10-13 cm) oraz brakiem związku z ładunkiem. Neutrony oraz protony mogą wymieniać ładunek między sobą na wskutek zderzeń. Energia związana z oddziaływaniami między składnikami jądra została określona jako energia wiązania jądra. Można wyznaczyć ją z różnicy masy przewidywanej np. w atomie helu (2p, 2n) wynoszącej 4,0319 u oraz doświadczalnej 4,0015 u. Wartość 0,03039 u nazwano defektem (inaczej niedoborem) masy. Energię wylicza się z równania Einsteina:
E = mc2
Jej wartość wskazuje na to jaka energia musi być dostarczona, by rozbić jądro albo jaka ilość jest wydzielona podczas jego tworzenia. Wzrost energii wiązania oraz defektu masy czyni jądro bardziej trwałe stabilne.
Jądra trwałe to takie, które:
- Posiadają równe ilości protonów i neutronów
- Posiadają parzyste ilości protonów oraz neutronów
- Stosunek protonów do neutronów wynosi 2 : 3
W pozostałych przypadkach następuje samorzutny rozpad.
Ostatnimi cząstkami, wchodzącymi w skład jądra atomowego, są elektrony. Charakteryzują się masą spoczynkową równą 0,000548 u (czyli ok. 1/1836 masy protonu) oraz elementarnym ładunkiem ujemnym wynoszącym -1,6x10-19C. Ponieważ, jak już wspomniano atom jest układem elektrycznie obojętnym, liczba protonów jest równa liczbie elektronów. W przypadku metali pewna ilość elektronów istnieje w postaci nie związanej z danym jądrem i dlatego może poruszać się w całym obszarze kryształu.
W Tabeli 1 podsumowano własności fizyczne cząstek elementarnych.
|
nazwa
|
Symbol
|
Masa [u]
|
Ładunek elektryczny
|
|
proton
|
p
|
1,0073
|
+1
|
|
neutron
|
n
|
1,0087
|
0
|
|
elektron
|
e-
|
0,00055
|
-1
|
Tabela 1. Charakterystyka cząstek elementarnych
Skład atomowy charakteryzują dwie liczby: atomowa (Z) i masowa (A):
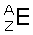
Liczba atomowa jest równa ilości protonów znajdujących się w jądrze atomowym. Stanowi ona zarazem liczbę porządkową.
Liczba masowa stanowi sumę nukleonów jądra atomowego.
Pierwiastek jest zbiorem atomów o identycznej liczbie atomowej.
Pierwiastki mogą występować a postaci różnych izotopów (są to atomy danego pierwiastka o różnej masie, co spowodowane jest różną ilością neutronów wchodzących w skład jądra). Terminem nuklidy określa się rodzaj atomów o określonym jądrze, to znaczy o określonej liczbie protonów i neutronów w jądrze.
Masy atomowe i cząsteczkowe
Masy atomów bądź cząsteczek wyrażone są w specjalnych jednostkach masy unitach [u]. 1u odpowiada 1/12 masie atomu węgla izotopu 12C. Przy obliczaniu stosuje się przeliczniki:
1 u = 0,166 * 10-23 g
1 g = 6,023 * 10 23 u
Masa bezwzględna jest podawana w gramach.
Masa atomowa danego pierwiastka jest wyrażona w jednostkach masy atomowe [u], stanowi masę atomu tego pierwiastka.
Masa cząsteczkowa danego pierwiastka jest wyrażona w jednostkach masy atomowe [u], stanowi masę cząsteczki tego pierwiastka.
Masa cząsteczkowa danego związku chemicznego wyrażona jest w jednostkach masy atomowe [u], stanowi masę tego związku, jest sumą składników wchodzących w skład związku.
Każda reakcja chemiczna podlega prawu zachowania masy, mówiącym, że masa substratów reakcji jest równa masie produktów tej reakcji.
Izotopy, izotony, izobary
Izotopy to odmiany atomów tego samego pierwiastka, o takiej samej liczbie atomowej, a różnej liczbie masowej, czyli o tej samej liczbie protonów, różniące się liczbą neutronów w jądrze. Pierwiastki charakteryzujące się nieparzystą liczbą atomową posiadają maksymalnie dwa izotopy (wyjątkami są wodór oraz potas), zaś – parzystą mają więcej niż dwa izotopy. Rekordzistą jest cyna posiadająca 10 odmian. Niektóre pierwiastki nie posiadają izotopów tak jak: glin, sód, beryl, fluor. Jedynie atomy wodoru oznacza się innymi symbolami (P, D, T). Zbiór atomów określonego izotopu nazywa się nuklidem. Izotopy charakteryzują się jednakowymi własnościami chemicznymi, a odmiennymi fizycznymi.
Masę atomową danego pierwiastka wyraża średni skład procentowy jego izotopów występujących w naturze:
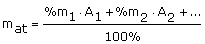
gdzie:
%m1, %m2 - procentowy udział izotopów
A1, A2 - liczby masowe izotopów
Izobary posiadają identyczną liczbę masową, a różną atomową, zatem stanowią atomy różnych pierwiastków.
Izotony stanowią atomy różnych pierwiastków posiadających identyczną liczbę neutronów.
Promieniotwórczość
Zjawisko to polega na samorzutnym rozpadzie jąder atomowych pierwiastków radioaktywnych. Taka zdolność posiadają szczególnie pierwiastki o znacznych masach atomowych.
Rodzaje przemian:
Promieniowanie α
Jest charakterystyczne dla pierwiastków o liczbie masowej większej od 210. Proces ten można zapisać schematem:
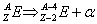
Cząstka α stanowi jądro helu.
- Promieniowanie ß-
Występuje w atomach zawierających więcej neutronów niż protonów. Przemianę tą można przedstawić jako:
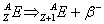

Promieniowanie ß+
Taki rodzaj emisji występuje w izotopach promieniotwórczych wytworzonych sztucznie.
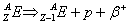
p - pozyton
Podczas rozpadu powstają bardzo często inne pierwiastki radioaktywne, których jądra mogą ulegać dalszemu rozczepieniu.
Pierwiastki promieniotwórcze ułożone są w trzech szeregach:
- Szereg uranowo-radowy (pochodzi od 23892U)
- Szereg torowy (pochodzi od 23290Th)
- Szereg uranowo-aktynowy (pochodzi od 23592U)
Szeregi promieniotwórcze zakończone są trwałymi izotopami ołowiu. Pierwiastki radioaktywne mają określony okres półtrwania (t0,5), czyli czas potrzebny do rozpadu połowy izotopów.
Zastosowanie pierwiastków promieniotwórczych w postaci energii jądrowej
Pochodzi ona z rozczepienia ciężkich jąder takich jak: uran, pluton czy tor albo z syntezy pierwiastków o małej masie, np. lit, hel. Energia ta związana jest z pękaniem wiązań jądrowych.
Jedynie w węglowych reaktorach udało się kontrolować proces, natomiast w pozostałych przypadkach reakcja jądrowa jest niekontrolowana.
W 1938r. odkryto, że niektóre izotopy ulegają rozczepieniu. Bazując na tym zjawisku prowadzono badawcze projekty militarne, np. Manhattan Project, podczas II Wojny Światowej prowadzące do powstania bomby atomowej.
Po wojnie, w latach 50 i 60 podejmowano próby, w ramach inżynierii jądrowej, tworzenia żelowych kanałów na terenie Ameryki Środkowej czy odwrócenia biegu syberyjskich rzek czy powstawania sztucznych jezior.
Zagrożenia związane z radioaktywnością
- Wpływ na organizmy żywe
Wszystkie istoty ziemskie narażone są na promieniowanie jonizujące. Zmiany, jakie powoduje takie promieniowanie zależą od: rodzaju i natężenia promieniowania, jego energii, lokalizacji źródła promieniowania, czasu ekspozycji czy rodzaju tkanki. Za dawkę wywołującą śmierć w 50% uważa się 4 silwerty. Skutkami są zaburzenia przemian zachodzących w organizmie. Bywa, że ujawniają się one w jakiś czas po napromieniowaniu dotyczy to zwłaszcza struktury DNA oraz zmian w chromosomach. Skutkiem ekspozycji na promieniowanie są: białaczka (następuje uszkodzenie szpiku kostnego), złośliwe nowotwory skóry oraz kości, zaburzenia układu pokarmowego, a także zaćma. Radiacja wywołuje liczne zaburzenia genetyczne. Te zaś objawiają się w następnych pokoleniach wrodzonymi wadami genetycznymi, często uniemożliwiającymi prawidłowe funkcjonowanie.
- Zmiany klimatyczne, przy braku kontroli nad radiacją izotopów
Broń jądrowa
Inaczej zwana jest bronią masowego rażenia. Energia atomowa pochodzi z rozczepienia albo syntezy. Broń nuklearną transportuje się w samolotach, rakietach, w postaci min. Szkodliwe dla wszystkich organizmów są efekty działania tych środków: promieniowania cieplnego i przenikliwego, fali uderzeniowej, a także opadu promieniotwórczego.
Promieniowanie może mieć swoje źródło na zewnątrz (wtedy jest mniej niebezpieczne, ze względu na możliwość usunięcia podczas mycia) lub wewnątrz organizmu, przedostając się przez skórę, układy oddechowy czy pokarmowy. Jest to dużo niebezpieczniejsze od radiacji zewnętrznej ponieważ nawet niezbyt przenikliwe promieniowanie powoduje silną jonizację.
Szkodliwe dla człowieka jest narażenie na silne pole magnetyczne wytwarzane przez linie wysokiego napięcia. Powoduje to zaburzenia środowiska komórkowego poprzez udar cieplny wywołujący zmianę struktur białkowych. Konsekwencjami takiego stanu są upośledzenie funkcjonowania układu krwionośnego czy słuchu i wzroku. W najtrudniejszej sytuacji znajdują się operatorzy urządzeń wytwarzających pole magnetyczne. Cierpią oni bardzo często na chorobę radiofalową (mikrofalową), której objawami są: bóle głowy, nerwowość, objawy nerwicowe, pieczenie oczu i łzawienie, oczopląs, suchość skóry, wypadanie włosów, arytmia serca oraz zaburzenie błędnika.
Należy zaznaczyć, że schorzenie to ujawnia się dopiero po kilku latach, a samo promieniowanie nie jest widoczne ani dla oczu, ani nie można go zidentyfikować od razu, bo nie wywołuje natychmiastowych zmian w organizmie.
W dzisiejszych czasach większość mieszkańców Ziemi narażona jest na promieniowanie elektromagnetyczne wytwarzane sztucznie, a jego skutki są zależne od np. uprzemysłowienia, skupienia stacji nadawczych, odbiorników czy lotnisk. Gdy częstotliwość pola elektromagnetycznego przekracza wartość 50Hz, wówczas wpływa ono toksycznie na organizmy roślinne oraz zwierzęce. U istot samożywnych następuje opóźnienie wegetacji oraz zmiany anatomiczne, u cudzożywnych: nieprawidłowości funkcjonowania układu krwionośnego, nerwowego, płciowego, zaburzenia wzrostu.
Człowiek rocznie jest poddawany promieniowaniu 2,4 milisiwertów, co jest związane z naturalnymi procesami, a za dawkę maksymalną uważa się 3 milisiwerty.
Zjawisko promieniotwórczości z jednej strony jest alternatywą do uzyskania olbrzymich ilości energii, w obliczu wyczerpujących się surowców pochodzenia naturalnego, a z drugiej – tajemnicza energią, która nie została poznana do końca, zarówno pod względem działania na organizmy żywe, jak i nie nauczono się jej kontrolować.
Struktura elektronowa atomów
Ilość elektronów określa liczba atomowa. Cząstka ta posiada dwoistą naturę: raz zachowuje się jak korpuskuła (cząstka), innym razem jako fala (badania de Broglie’a). Elektron znajduje się w przestrzeni wokół jądra, ale nie da się określić dokładnie jego położenia. O zależności pędu od położenia elektronu mówi zasada nieoznaczoności Heisenberga. Jeśli jedna z tych wartości jest wyznaczona precyzyjniej to druga posiada dużą rozpiętość wartości.
Dlatego można mówić o prawdopodobieństwie znalezienia elektronu w przestrzeni międzyjądrowej.
Stan elektronu opisuje funkcja falowa (zwana także orbitalem), a kwadrat jej wartości stanowi gęstość elektronową.
Każdy elektron charakteryzowany jest prze cztery liczby kwantowe:
Główna liczba kwantowa (n)
n = 1,2,3,4... , n
n jest równe numerowi powłoki, a maksymalna liczba elektronów na danej powłoce wyraża wzór:
2n2
Poszczególne powłoki oznacza się za pomocą liter:
|
Nr powłoki
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Symbol
|
K
|
L
|
M
|
N
|
O
|
P
|
Q
|
Główna liczba kwantowa odpowiada za energię całkowitą elektronu:
E = - 1/n2 * E1
Gdzie: n - główna liczba kwantowa
E1 = 13,6 eV - bezwzględna wartość elektronu wodoru w stanie podstawowym
Wartość energii zwiększa się w miarę wzrostu odległości elektronu od jądra.
Stan atomu, w którym elektrony dążą do osiągnięcia jak najmniejszej energii, nazywa się stanem podstawowym. Stan wzbudzony atomu jest związany z pochłonięciem energii.
Od wartości głównej liczby kwantowej zależy rozmiar orbitalu (wzrost n powoduje wzrost obszaru orbitalnego).
Poboczna liczba kwantowa (l)
Nazywana także orbitalną liczbą kwantową. Od jej wartości zależy liczba podpowłok, wchodzących w skład powłoki.
Przyjmuje ona wartości:
0 ≤ l ≤ (n -1)
Wartości pobocznej liczby kwantowej dla poszczególnych powłok kształtują się następująco:
|
l
|
0
|
1
|
2
|
3
|
4
|
5
|
|
podpowłoka
|
s
|
p
|
d
|
f
|
g
|
h
|
Wartość pobocznej liczby kwantowej wpływa na kształt orbitalu oraz moment pędu elektronu.
Poniżej przedstawiono kształty orbirali.
s

p
d
Magnetyczna liczba kwantowa (m)
Jej wartość mieści się w granicach:
-l < m < l
Określa ona przestrzenne rozmieszczanie orbitalu. Jej wartość mówi o liczbie orbitali znajdujących się w danej podpowłoce. Poniżej przedstawiono orbitale dla poszczególnych podpowłok.
|
Podpowłoka
|
Liczba orbitali
|
Typ orbitali
|
|
s
|
1
|
s
|
|
p
|
3
|
px , py , pz
|
|
d
|
5
| |
|
f
|
7
|
Spinowa liczba kwantowa (ms)
Decyduje o orientacji spinu elektronu, przyjmuje jedynie dwie wartości:
ms = +1/2 lub
ms = -1/2
Ponieważ na każdym orbitalu znajdują 2 elektrony, zatem na poszczególnych podpowłokach znajduje odpowiednia ilość elektronów:
|
Podpowłoka
|
s
|
p
|
d
|
f
|
|
Liczba elektronów
|
2
|
6
|
10
|
14
|
W układach wieloelektronowych należy wziąć pod uwagę oddziaływania pomiędzy jądrem a elektronami oraz odpychaniem elektronu z innymi elektronami. Gdy elektrony rozpatruje się oddzielnie to mamy do czynienia
z przybliżeniem jednoelektronowym.
Konfiguracja elektronowa
Konfiguracją elektronową nazywamy lokalizację elektronów na poszczególnych powłokach
i podpowłokach.
Elektrony rozmieszczone są zgodnie z dwoma regułami:
- Zakazem Pauliego mówiącym, że elektrony różnią się pomiędzy sobą przynajmniej jedna liczbą kwantową
- Reguła Hunda dotyczy konfiguracji poziomów energetycznych: elektrony rozmieszczone są w taki sposób, by liczba elektronów niesparowanych była jak największa, wykazywały one jednakowy spin
Elektrony sparowane, to takie, które posiadają orientacje przeciwną, różnią się liczbą ms.
Opisując stan elektronowy w atomie stosuje się powyższe zasady:
- Ilość powłok jest równa numerowi okresu
- Liczba elektronów walencyjnych ( na ostatniej powłoce) jest równa numerowi grupy dla grup 1 i 2,
- a dla grup 13-18 wynosi nr grupy – 10
- Pierwiastki grup 1,2,13,14,15,16,17,18 zapełniają ostatnią powłokę, grup 3-12 przedostatnia,
- a lantanowce i aktynowce – drugą od końca
- Pierwiastki łącząc się w związki chemiczne, dążą do uzyskania konfiguracji najbliższego gazu szlachetnego, a więc uzyskania dubletu lub oktetu elektronowego
Elektrony umieszcza się na orbitalach wykazujących możliwą najniższą energię:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d 4f 6p itd.
Konsekwencje struktury elektronowej:
- Dla pierwiastków grup 1 i 2 jej numer określa liczbę elektronów walencyjnych, w przypadku grup 13 – 18 liczba ta wynosi nr grupy – 10
- Numer okresu jest równy ilości powłok elektronowych
- Liczba atomowa określa liczbę protonów (elektronów)
- Liczbę neutronów wyznacza się z zależności:
n = A – Z