Sole to związki o budowie jonowej, złożone z dodatnio naładowanych kationów metali oraz z ujemnie naładowanych anionów reszt kwasowych. Powstają w wyniku wielu rodzajów reakcji, jednak jeden typ najlepiej przedstawia, sposób powstawania soli – to reakcja zobojętniania:
Kwas + wodorotlenek metalu → sól + wodę
W wyniku reakcji substancji o charakterze chemicznym zasadowym (wodorotlenek) i kwasowym (kwas), powstaje substancja o odczynie chemicznym obojętnym, czyli sól.
Na podstawie tej reakcji widać, że sole to pochodne kwasów, w cząsteczkach których atomy wodoru zostały zastąpione atomami metalu.
Wzór ogólny będący zapisem soli ma postać:
MnRm, gdzie:
M- atom metalu
R- reszta kwasowa
n- wartościowość reszty kwasowej
m- wartościowość metalu
Nazewnictwo:
Nazwy soli tworzy się od nazwy kwasu, z którego sól powstał oraz od nazwy metalu. Najpierw wymienia się część oznaczającą anion, a potem część oznaczającą kation.
W przypadku reszt kwasów tlenowych, do nazwy kwasu dodaje się końcówkę –an, zamiast pierwotnej końcówki –owy.
Np. MgSO4 nazwiemy: siarczan (VI) magnezu (od nazwy kwasu siarkowego (VI)).
W przypadku reszt kwasów beztlenowych, do nazwy kwasu dodaje się końcówkę –ek, zamiast pierwotnej końcówki –wodorowy.
Np. NaCl nazwiemy: chlorek sodu (od nazwy kwasu chlorowodorowego).
Podstawowe reakcje, w wyniku których można otrzymać sole:
kwas + zasada → sól + woda (reakcja zobojętniania)
HBr + NaOH → NaBr + H2O
kwas + metal → sól + wodór
HNO3 + Na → NaNO3 + ½ H2↑
kwas + tlenek metalu → sól + woda
H2SO3 + MgO → MgSO3 + H2O
zasada + tlenek niemetalu → sól + woda (tak otrzymuje się jedynie sole pochodzące od kwasów tlenowych)
2 NaOH + SO2 → Na2SO3 + H2O
tlenek metalu + tlenek niemetalu → sól (tak otrzymuje się jedynie sole pochodzące od kwasów tlenowych)
Na2O + CO2 → Na2CO3
metal + niemetal → sól ( w ten sposób otrzymuje się jedynie sole pochodzące od kwasów beztlenowych)
2 Na + Cl2 → 2 NaCl
sól 1 + sól 2 → sól 3 + sól 4
CuCl2 + K2CO3 → CuCO3↓ + 2 KCl
sól 1 + zasada 1→ sól 2 + wodorotlenek 2
AlCl3 + 3 NaOH → Al(OH)3↓ + 3 NaCl
sól 1 + kwas 1 → sól 2 + kwas 2
CaCl2 + 2 HNO3 → Ca(NO3)2 + 2 HCl
sól 1 + metal 1 → sól 2 + metal 2
AlCl3 + 3 Na → 3 NaCl + Al
Dysocjacja:
Sole w roztworach wodnych ulegają dysocjacji elektrolitycznej, czyli rozpadowi pod wpływem cząsteczek wody na kationy metali oraz aniony reszt kwasowych. Dzięki temu rozpadowi sole mają zdolność przewodzenia prądu elektrycznego (są dobrymi elektrolitami). Takie same zdolności przewodnictwa elektryczności posiadają sole w stanie stopionym. Taką samą zdolność posiadają kwasy oraz zasady, które podobnie jak sole ulegają w wodzie dysocjacji.
Przykłady reakcji dysocjacji:
KNO2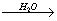 K+ + NO2-
K+ + NO2-
Cząsteczka azotanu (III) potasu pod wpływem wody dysocjuje na jednododatni kation potasu oraz jednoujemny anion azotanowy (III).
MgBr2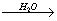 Mg2+ + 2 Br-
Mg2+ + 2 Br-
Na3PO4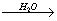 3 Na+ + PO43-
3 Na+ + PO43-
MgSO3 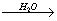 Mg2+ + SO32-
Mg2+ + SO32-
Charakterystyka ważniejszych soli (wg ich reszt kwasowych)
Azotany (V)
Azotany (V) to sole kwasu azotowego (V), posiadające w swoich cząsteczkach anion azotanowy (V)- NO3-.
Sole te są bardzo dobrze rozpuszczalne w wodzie, maja właściwości utleniające oraz higroskopijne (pochłaniają wilgoć).
Azotany (V) znajdują zastosowanie jako nawozy sztuczne, są bardzo dobrze wchłaniane przez rośliny i dostarczają im pierwiastków niezbędnych do rozwoju. Niestety nadmiar azotanów w glebie łatwo zanieczyszcza zbiorniki wodne, przyczyniając się do rozwoju w nich glonów, a tym samym może się przyczynić do śmierci z niedotlenienia żyjących w nich ryb.
Azotany są też składnikami materiałów wybuchowych, produkuje się z nich proch strzelniczy.
Fosforany (V)
Fosforany (V) to sole kwasu fosforowego (V), posiadające w swoich cząsteczkach anion fosforanowy (V) – PO43-.
Rozpuszczalność tych soli jest różna w zależność od atomu metalu budującego cząsteczkę fosforanu. Ogólnie lepiej rozpuszczalne są wodorfosforany (fosforany, w których nie wszystkie atomy wodoru zostały podstawione atomami metalu).
Fosforany (V) znajdują zastosowanie jako nawozy sztuczne, są bardzo dobrze wchłaniane przez rośliny i dostarczają im pierwiastków niezbędnych do rozwoju. Najpopularniejsze nawozy fosforowy to: superfosfaty . Podobnie jak w przypadku azotanów (V) zbyt duża ich ilość w glebie prowadzi do zanieczyszczenia wody, a w efekcie do wzmożonego rozwoju roślin wodnych i śmierci ryb.
Siarczany (VI).
Siarczany (VI) to sole kwasu siarkowego (VI), posiadające w swoich cząsteczkach anion siarczanowy (VI) – SO42-.
Siarczany występują w przyrodzie naturalnie w postaci różnych minerałów m.in. jako gips czyli uwodniona sól siarczanu wapnia, używana głównie w medycynie jako opatrunek usztywniający. Sole te spełniają wielorakie funkcje w życiu codziennym człowieka. Siarczan magnezu , znany często jako sól gorzka to farmaceutyk, zawarty jest także w leczniczych wodach źródlanych. Znajduje także zastosowanie przy produkcji materiałów ogniotrwałych. Siarczany sodu są wykorzystywane w przemyśle papierniczym, szklarskim. Inne siarczany tworzą przepiękne minerały wykorzystywane w jubilerstwie (np. alabaster).