Hydroliza
Hydrolizą nazywa się ogólnie reakcję związku chemicznego z wodą. Najbardziej znanym jest hydroliza soli w środowisku wodnym:
- słabych kwasów i mocnych zasad - odczyn zasadowy (hydroliza zasadowa);
- słabych zasad i mocnych kwasów - odczyn kwasowy (hydroliza kwasowa);
- słabych kwasów i mocnych zasad - odczyn słabo zasadowy lub słabo kwasowy albo obojętny
Nie ulegają natomiast hydrolizie roztwory soli mocnego kwasu i mocnej zasady.
Produktami reakcji hydrolizy są kwas oraz zasada danej soli. Na przykład dla soli kwasu jednoprotonowego i zasady jednowodorotlenowej (MeA) schematycznie można opisać równanie hydrolizy:
Me+ + A- + H2O <=> MeOH + HA
Elektrochemia
Elektrochemia jest to dział chemii, który bada procesy chemiczne towarzyszące przepływowi prądu elektrycznego przez elektrolit. Elektrolitem, nazywamy związek chemiczny przewodzący prąd elektryczny i jest to:
- stopiona sól,
- kwasy, zasady, albo ich sole, jako roztwór albo cieczy;
Ogniwo galwaniczne jest to układ dwóch elektrod zanurzonych w roztworze jonów, który jest w stanie przekazywać energię powstałą w wyniku reakcji chemicznych między elektroda, a elektrolitem (jako prąd elektryczny) od razu do środowiska.
Różnica potencjałów elektrod w stanie równowagi ogniwa to siła elektromotoryczna (SEM). Jest to:
- miara tzw. równowagi ogniwa, w czasie, gdy nie pracuje. Inaczej SEM jest to
- norma predyspozycji ogniwa do przekazywaniu na zewnątrz układu prądu elektrycznego (energii), pochodzącej z reakcji chemicznych
- ważny parametr, definiujący energię procesów chemicznych;
- parametr określający stężenie jonów w danym roztworze;
Potencjał, każdej z elektrod pozwala obliczyć wzór Nernsta:
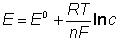
gdzie: E - potencjał elektrody;
E0 - standardowy potencjał elektrody (układu redoksowego),
R - stała gazowa
T - temperatura w Kelwinach,
F - stała Faradaya (9,6485*104 C/mol)
N - ilość elektronów ulegająca wymianie w procesie elektrodowym,
c - stężenie jonów
Elektroda jest to kawałek metalu zanurzony w roztworze własnych jonów o stężeniu c= 1mol/dm3, jest to tzw. półogniwo standardowe. Jeśli zmierzy się potencjał tego półogniwa w temperaturze 298 K względem elektrody wodorowej, i jest to tzw. standardowy potencjał elektrodowy.
Standardowa elektroda wodorowa zbudowana jest z płytki platynowej pokrytej warstewką czerni platynowej, posiadającej właściwość absorbowania wodoru gazowego. Nasycona gazowym wodorem płytka platynowa nie bierze bezpośredniego udziału w reakcji elektrodowej, ale zachowuje się tak, jakby była elektrodą wykonaną z samego wodoru. Wartość potencjału standardowej elektrody wodorowej przyjęto umownie jako zero, a potencjały innych elektrod właśnie wyraża się względem jej.
Usystematyzowanie potencjałów standardowych poszczególnych metali umożliwia obliczenie siły elektromotorycznej dowolnego ogniwa elektrochemicznego oraz powinowactwa chemicznego reakcji, która w nim zachodzi. Jest to tzw. szereg elektrochemiczny (inaczej zwany szeregiem napięciowym) metali ułożonych od najniższego do najwyższego potencjału. Z położenia w szeregu danego metalu możemy wnioskować o jego aktywności, tj.:
- wraz ze wzrostem potencjału aktywność metali maleje;
- metal mniej aktywny jest wypierany przez metal o niższym potencjale, czyli bardziej aktywny;
- metale mające potencjał niższy od potencjału wodoru wypierają proton wodoru z kwasów;
Prawa elektrolizy Faradaya
1. Masa związku wydzielonego na jednej z elektrod jest proporcjonalna do natężenia prąd elektrycznego a także do przebiegu elektrolizy
m = kIt
gdzie k - równoważnik elektrochemiczny; cecha charakteryzująca substancję wydzielającą się na
powierzchni elektrody;
I - natężenie prądu płynącego przez elektrolit w czasie t
M - masa substancji wydzielonej na powierzchni elektrody powstała podczas
przepływu przez elektrolit ładunku jednostkowego, przykładowo 1 C
Jest ono także znane, z innej definicji:
stosunek mas m1 i m2 wydzielonych na elektrodach substancji podczas przepływu jednakowych ładunków elektrycznych, jest równy stosunkowi ich równoważników elektrochemicznych R1 i R2
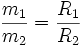
2. Stosunek molowej masy (M) substancji powstałej na elektrodach do iloczynu liczby ładunkowej (z) reakcji zapisanej względem 1 mola oraz równoważnika elektrochemicznego tej substancji jest stały dla wszystkich reakcji zachodzących na elektrodach i wynosi 96500 C:
F= M/kz
Podczas elektrolizy:
- Kwasów - zazwyczaj na katodzie wydziela się wodór
zaś na anodzie
- tlen, jeśli są to kwasy tlenowe; w przypadku rozcieńczonych roztworów, pochodzący zazwyczaj z wody;
- inne produkty, pochodzące z utlenienia reszty kwasowej, np. Cl z HCl, w przypadku beztlenowych kwasów;
- Zasad - w wyniku rozkładu wody, przy dużych rozcieńczeniach, na katodzie wydziela się wodór, jeśli jednak metal leży za wodorem w szeregu napięciowym to na katodzie zamiast wodoru wydzieli się metal;
Zaś na anodzie tlen;
- Sole w roztworach - na katodzie podobnie jak przy zasadach,
zaś na anodzie tlen z wody, jeśli jest to reszta kwasu tlenowego; lub też niemetal dla soli powstałych z kwasu beztlenowego;
- Sól stopiona - na katodzie metal
na anodzie wydziela się niemetal;
- Zasada stopiona - na katodzie metal
na anodzie tlen pochodzący z grupy hydroksylowej (-OH)